幚巤擔丂暯惉侾俆擭侾寧侾俈擔乮嬥乯
侾丏 栚揑
丂曻幩慄偺嵶朎偵懳偡傞嵟傕尠挊側岠壥偼嵶朎巰偺桿摫偱偁傞丅崱夞偺幚廗偱偼倃慄偺徠幩偵傛傝桿摫偝傟傞嵶朎巰乮傾億僩乕僔僗乯傪棟夝偡傞嫟偵丄偦偺娙曋側専弌朄傪妛傇丅
俀丏 彉榑
丂嵶朎偼惗懱傪峔惉偡傞婎杮扨埵偱偁傞丅壗庬椶偐偺嵶朎偑廤傑偭偰慻怐傪峔惉偟丄慻怐摨巑偺憡屳嶌梡偵傛傝偦傟偧傟偺婍姱偑婡擻偟偰偄傞丅曻幩慄偺惗懱偵懳偡傞塭嬁偼丄偙偆偟偨憡屳嶌梡傪娷傔偨惗懱慡懱傊偺塭嬁偲偟偰棟夝偝傟側偗傟偽側傜側偄偑丄婎杮揑偵偼嵶朎偵懳偡傞塭嬁傪斀塮偟偰偄傞丅
丂曻幩慄偺嵶朎偵懳偡傞塭嬁偺拞偱嵟傕尠挊側傕偺偼嵶朎巰偺桿摫偱偁傞丅曻幩慄帯椕偼曻幩慄偵傛傞偑傫嵶朎偺嵶朎巰傪桿摫偡傞偙偲偱惉傝棫偭偰偍傝丄傑偨曻幩慄偺戝検旐敇偵傛傞屄懱巰偼寣媴宯傗挵偺姴嵶朎側偳偺嵶朎巰偵傛偭偰傕偨傜偝傟傞丅
丂嵶朎巰偵偼宍懺揑丒惗棟妛揑偵嬫暿偝傟傞俀庬椶偑偁傞丅彎奞偵傛傝捈愙揑偵嵶朎峔憿偁傞偄偼婡擻偑攋夡偝傟偰堷偒婲偙偝傟傞庴摦揑側嵶朎巰偼僱僋儘乕僔僗乮necrosis丗夡巰乯偲屇偽傟傞丅偙傟偵懳偟丄懝彎偁傞偄偼惗棟揑側乽巰偺僔僌僫儖乿偵墳摎偟偰丄嵶朎撪偺戙幱斀墳偺寢壥偲偟偰堷偒婲偙偝傟傞擻摦揑側嵶朎巰偼傾億僩乕僔僗乮apoptosis乯偲屇偽傟偰偄傞丅傾億僩乕僔僗傪堷偒婲偙偟偨嵶朎偵偼丄妀偺抐曅壔丄妀撪僋儘儅僠儞偺嬅弅丄嵶朎偺暘抐壔乮傾億僩乕僔僗彫懱偺宍惉乯側偳偺宍懺揑摿挜偑娤嶡偝傟傞丅偙偺傛偆側嵶朎偺僎僲儉俢俶俙傪傾僈儘乕僗僎儖揹婥塲摦偵偐偗傞偲丄180乣200墫婎懳偺惍悢攞偺挿偝偺俢俶俙抐曅偑婯懃揑偵暲傫偩丄偄傢備傞乽俢俶俙儔僟乕乮偼偟偛忬偵暲傫偩俢俶俙抐曅乯乿偑娤嶡偝傟傞丅偙傟偼傾億僩乕僔僗傪堷偒婲偙偟偨嵶朎撪偱偼丄傾億僩乕僔僗摿堎揑偵妶惈壔偝傟傞俢俶俙暘夝峺慺偑僎僲儉俢俶俙傪僰僋儗僆僜乕儉扨埵偱愗抐偡傞偐傜偱偁傞丅
丂崱夞偺幚廗偱偼丄倃慄徠幩偝傟偨嵶朎偐傜僎僲儉俢俶俙傪挷惍偟偨屻丄傾僈儘乕僗僎儖揹婥塲摦朄偱夝愅偟丄俢俶俙儔僟乕傪専弌偡傞偙偲偵傛傝丄倃慄徠幩偑嵶朎偺傾億僩乕僔僗傪堷偒婲偙偡偙偲傪妋擣偡傞丅
俁丏 幚尡
嘆 俥俵俁俙乮儅僂僗擕娻桼棃偺晜梀嵶朎乯偵倃慄傪俈Gy徠幩偟丄俁擔娫攟梴偟偨屻偵 屄偺嵶朎傪墦怱偟偰廤傔傞丅嵶朎傪俹俛俽乮儕儞巁娚徴惗棟怘墫悈乯偵晜梀偝偣丄愻忩偟偨屻丄侾ml偺俹俛俽偵寽戺偟丄儅僀僋儘僠儏乕僽偵堏偡丅乮偙偙傑偱弨旛偝傟偨傕偺傪庴偗庢偭偨乯
嘇 崅懍旝検椻媝墦怱婍偱墦怱乮2,500rpm丄俆暘娫乯偟偨屻丄僺儁僢僩儅儞P-200傪梡偄偰忋惔傪彍偄偨丅忋惔偼攑塼擖傟偵幪偰偨丅僺儁僢僩儅儞P-200傪梡偄偰Lysis
Buffer乮帀朾巁傪梟偐偡摥偒乯傪100兪l壛偊丄傛偔崿偤偨屻丄昘拞偵10暘娫偍偄偨丅
嘊 墦怱乮15,000rpm丄10暘娫丄係亷乯屻丄僺儁僢僩儅儞P-200傪梡偄偰忋惔傪怴偨側儅僀僋儘僠儏乕僽偵堏偟偨丅
嘋 僺儁僢僩儅儞P-20傪梡偄偰RNase A梟塼傪係兪l壛偊丄傛偔崿偤偨屻37亷偱30暘娫張棟偟偨丅
嘍 僺儁僢僩儅儞P-20傪梡偄偰Proteinase K梟塼傪係兪l壛偊丄傛偔崿偤偨屻37亷偱30暘娫張棟偟偨丅
嘐 僺儁僢僩儅儞P-20傪梡偄偰俆俵 NaCl梟塼乮仸傾儖僐乕儖捑揳偵昁梫乯傪俆兪l壛偊傛偔崿偤偨屻丄僺儁僢僩儅儞P-200傪梡偄偰120兪l偺僀僜僾儘僷僲乕儖傪壛偊傛偔崿偤偨丅偦偺屻丄塼懱拏慺偱椻媝偟偨丅
嘑 墦怱乮15,000rpm丄10暘娫丄係亷乯屻丄僺儁僢僩儅儞P-200傪梡偄偰慡偰偺忋惔傪庢傝彍偄偨丅忋惔偼攑塼擖傟偵幪偰偨丅僺儁僢僩儅儞P-1000傪梡偄偰500兪l偺70亾僄僞僲乕儖傪壛偊丄儅僀僋儘僠儏乕僽偺傆偨傪偟偰潣漚偡傞偙偲偵傛傝捑揳乮僎僲儉俢俶俙乯傪愻忩偟偨丅嵞傃墦怱乮15,000rpm丄俆暘娫乯偟丄僺儁僢僩儅儞P-200傪梡偄偰忋惔傪姰慡偵庢傝彍偄偨丅
嘒 捑揳傪晽姡偝偣偨屻丄俿俤傪10兪l壛偊丄姰慡偵梟夝偝偣乮俢俶俙梟塼乯丄揹婥塲摦偺帋椏偲偟偨丅
嘓 僺儁僢僩儅儞P-20傪梡偄偰俢俶俙梟塼偵俀兪l偺Loading Dye傪壛偊丄傛偔崿偤偨丅
嘔 僺儁僢僩儅儞P-20傪梡偄偰Loading Dye偺擖偭偨俢俶俙梟塼10兪l傪庢傝丄1.5亾傾僈儘乕僗僎儖偺僂僃儖偵拲堄怺偔拲偓崬傒丄100V偱40暘娫揹婥塲摦偟偨丅
嘕 傾僈儘乕僗僎儖傪僄僠僕僂儉僽儘儅僀僪梟塼偱15暘娫張棟偟偨屻丄巼奜慄傪徠幩偟偰俢俶俙傪娤嶡偟丄幨恀嶣塭傪峴偭偨丅
係丏 寢壥
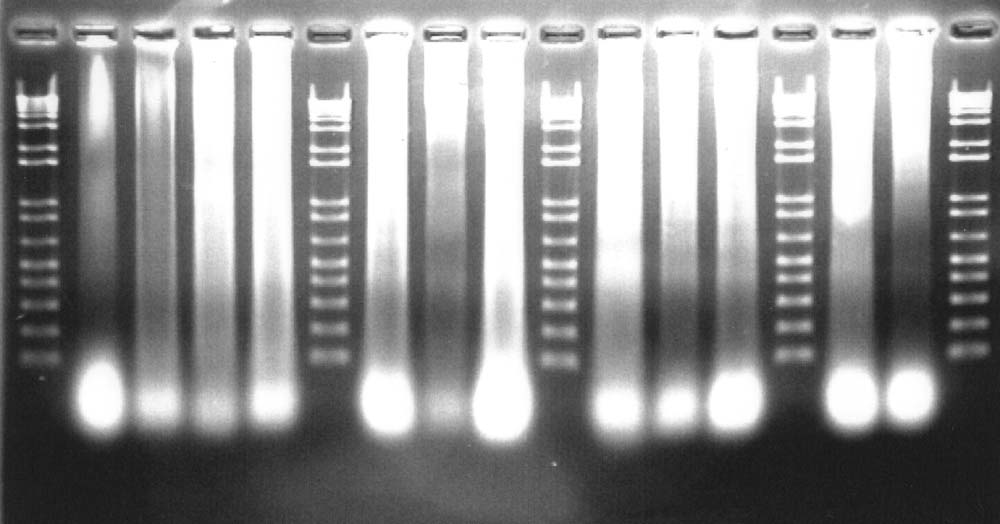
丂嶣塭偟偨幨恀偼埲壓偺傛偆偵側偭偨丅俉斍偺幚尡寢壥偼嵍偐傜侾俀楍栚丅乮塃偐傜俇楍栚乯

嵍偐傜侾丄俇丄侾侽丄侾係丄侾俈楍栚偼儅乕僇乕偱丄壓偐傜100丄200丄乧bp丅俀楍栚偑倃慄徠幩傪峴傢側偐偭偨嵶朎偺俢俶俙丅俁楍栚偐傜儅乕僇乕傪嫴傒側偑傜侾丄俀乧俋斍偺弴丅
俆丄俉丄俋斍偺傕偺偼斾妑揑偼偭偒傝偲尒傜傟傞偑丄400丄600bp傎偳偺偲偙傠偵敀偔側偭偨懷偑尒傜傟傞丅偙傟偼俀楍栚偺倃慄徠幩傪峴傢側偐偭偨傕偺偱偼尒傜傟偢丄偙傟偑倃慄徠幩偵傛傝嵶朎偑傾億僩乕僔僗傪婲偙偟偰巰傫偩偨傔偵偱偒偨俢俶俙儔僟乕偱偼側偄偐偲峫偊傜傟傞丅
偦傟傛傝忋曽偵尒傜傟傞敀偄晹暘偼夡傟偰偄側偄乮儔僟乕偵側偭偰偄側偄乯俢俶俙丄壓曽偵尒傜傟傞傕偺偼庢傝彍偗側偐偭偨俼俶俙偱偁傠偆偲峫偊傜傟傞丅
偙偺寢壥偐傜丄倃慄徠幩偑嵶朎偺傾億僩乕僔僗傪堷偒婲偙偡偙偲偑妋擣偝傟偨丅
俆丏 愝栤
乮侾乯傾億僩乕僔僗偲偼壗偐
丂恀妀懡嵶朎惗暔偺嵶朎偼憹怋丄暘壔丄榁壔側偳偺暋嶨側惗柦尰徾傪塩傓堦曽丄帺傜巰偸偙偲傕偱偒傞丅偙傟偼丄堚揱巕儗儀儖偱岻傒偵惂屼偝傟偨崌栚揑揑側惗柦尰徾偺堦偮偱傕偁傞丅偦傟偼柧傜偐偵庴摦揑側嵶朎枌婡擻攋抅偵巒傑傝丄墛徢斀墳傪敽偆偄傢備傞夡巰乮僱僋儘乕僔僗乯偲偼宍懺妛揑偵嬫暿偝傟偰偄傞丅傾億僩乕僔僗偱偼丄嵶朎偑堔弅丒抐曅壔偟丄嵶朎昞柺憌偺曄壔丄嵶朎幙偺嬅廤丄偟偽偟偽妀偺嬅廤丒抐曅壔傪敽偆偺偑摿挜偱偁傝丄撪梕暔偼曻弌偝傟側偄丅傾億僩乕僔僗偵傛偭偰巰偵偮偮偁傞嵶朎偼丄婷怘嵶朎乮儅僋儘僼傽乕僕乯偵偲傜偊傜傟丄堸傒崬傑傟傞丅乮偙傟偵懳偟夡巰偼丄嵶朎偑朿挘偟偰攋楐偟丄撪梕暔偑曻弌偝傟偰嵶朎幙偺彫婍姱偑攋夡偝傟傞偺偑摿挜偱偁傞丅乯
丂夡巰偼丄嵶朎偑惗偒傜傟側偄傛偆側廳偄忈奞偁傞偄偼娐嫬偺寖曄側偳偵弌夛偭偨寢壥婲偙傞傕偺偱丄庴摦揑巰偲尵偊傞偺偵懳偟偰丄傾億僩乕僔僗偼嵶朎撪奜偺忬嫷傪帺庡揑偵敾抐偟丄慖傫偩巰丄偡側傢偪愊嬌揑巰偲尵偊傞丅偙偺傾億僩乕僔僗婡峔偼敪惗偐傜屄懱宍惉丄偝傜偵宍懺婡擻堐帩丄嵶朎榁壔偐傜壥偰偼屄懱巰偵帄傞堦惗偺條乆側晳戜偱惗柦堐帩偺偨傔偵傕晄壜寚側尰徾偲偄偊傞丅扨嵶朎惗暔偵偼傾億僩乕僔僗偑側偄偙偲偐傜丄懡嵶朎惗暔偱偺惗柦堐帩偵偼晄壜寚偲峫偊傜傟傞丅
丂屄懱偺敪惗偐傜巰偵帄傞惗棟尰徾偱條乆側嵶朎巰偑娤嶡偝傟傞丅敪惗夁掱偱偺婍姱宍懺宍惉偱偼丄堚揱巕偱僾儘僌儔儉偝傟偨嵶朎巰偑昁恵偱偁傞丅偙傟偼僾儘僌儔儉嵶朎巰偲屇偽傟傞丅乮僆僞儅僕儍僋僔偐傜怟旜偑徚偊傞丄側偳乯偙傟偼惓忢側敪払偵昁恵偲偝傟偰偄傞丅屄懱偺惗柦堐帩傗慻怐傗婍姱偺宍懺婡擻堐帩偺偨傔偵嵶朎巰偼敪摦偝傟丄惉恖屄懱偵偍偄偰偼堎忢偵側偭偨傝丄晄梫偵側偭偨嵶朎偺惗懱偐傜偺彍嫀偵昁梫偲偝傟傞丅惓忢嵶朎偺岎戙丄寣媴傗惙傫側嵶朎岎戙偑偁傞徚壔娗忋旂傗旂晢偱偼嵟傕傛偔娤嶡偝傟偰偄傞丅堦曽丄幚幙憻婍偱偼嵶朎暘楐偑婬偱偁傞偨傔丄傾億僩乕僔僗偺婲偙傞昿搙傕彮側偄偲峫偊傜傟傞丅摉慠偺偙偲側偑傜丄條乆側幘昦傗偦偺帯椕偵敽偆堎忢嵶朎弌尰偵懳偟偰傕傛偔嵶朎巰偼娤嶡偝傟傞丅
丂僸僩偺応崌丄庴惛棏偺俆侽僷乕僙儞僩偼戀帣偵敪払偱偒偢偵丄泱敪払偺搑拞偱巰傫偱偟傑偆丅偙傟偼丄帺慠敪惗偡傞愼怓懱偺堎忢傪塻晀偵嶡抦偟丄嵶朎偑傾億僩乕僔僗傪婲偙偟偨寢壥偱偁傝丄幚嵺偵弶婜泱偺帺慠棳嶻偱偼丄偦偺傎偲傫偳偵愼怓懱堎忢偑尒偮偐傞丅儅僂僗偺幚尡偵偍偄偰傕丄弶婜泱偺抜奒偱曻幩慄傪徠幩偟偰傕丄戀撪巰朣棪偑忋徃偡傞偑丄婏宍偺敪惗棪偼忋徃偟側偄丅偟偐偟丄嵶朎偺傾億僩乕僔僗傪桿敪偡傞p53傪寚懝偝偣偨儅僂僗偱摨條偺曻幩慄徠幩傪峴偭偰斾妑幚尡傪峴偆偲丄戀撪巰丗婏宍丗惓忢偺斾偑丄寚懝偺側偄傕偺偱俇丗俀丗俀乮俀妱偺婏宍敪惗棪偼曻幩慄傪徠幩偟側偄傕偺偲摨偠乯丄寚懝偝偣偨傕偺偱侾丗俈丗俀偲側傞偲偄偆丅偮傑傝p53偼丄傾億僩乕僔僗傪桿敪偡傞偙偲偵傛傝丄婏宍偺敪惗傪杊偄偱偄傞偲尵偊傞偺偱偁傞丅
丂屄懱傪峔惉偡傞慡偰偺嵶朎偼傾億僩乕僔僗偺偨傔偺帺敋憰抲傪撪憼偟偰偍傝丄敪惗偺搑拞偱堦帪揑偵偱偒傞晄梫嵶朎傗丄廋暅晄壜擻側傎偳偵俢俶俙偵彎傪庴偗偨嵶朎偼偦偺帺敋憰抲偺僗僀僢僠傪墴偡偺偱偁傞丅偙偺婡峔偼屄懱偺惓忢側敪払偲寬峃偺堐帩偵偼晄壜寚偱偁傞偑丄夁忚傗晄懌偵傛傝丄偟偽偟偽昦婥偺尨場偲傕側傞丅
乮俀乯傾億僩乕僔僗傪婲偙偟偰偄傞嵶朎撪偱偼惗壔妛揑偵偼壗偑婲偙偭偰偄傞偐
乮俁乯傾億僩乕僔僗傪婲偙偟偰偄傞嵶朎偺愼怓懱俢俶俙偼偳偺傛偆側婡峔偱愗抐偝傟傞偐
丂偙傟傜偺婡峔偼堦楢偺夁掱偱偁傞偺偱丄堦弿偵弎傋傞丅
丂傾億僩乕僔僗偼偦偺桿摫偍傛傃梷惂僔僗僥儉偺僶儔儞僗偺忋偵岻傒側堚揱巕惂屼傪庴偗偰偄傞丅偦偺暘巕婡峔偼奜奅偐傜偺條乆側僔僌僫儖偺乮庡偵嵶朎枌忋偱偺乯僙儞僒乕僔僗僥儉丄嵶朎撪偺僔僌僫儖揱払丄妀撪揮幨場巕偵傛傞堚揱巕敪尰傪夘偟丄嵟廔揑偵偼傾億僩乕僔僗偺惗壔妛揑幚峴僔僗僥儉偵傛傝妶惈壔偝傟傞丅
丂嵶朎偼奜奅偺忬嫷偵傛傝丄偍偺偍偺堎側傞暘巕傪夘偟偰惗懚僔僗僥儉偲巰偺僔僗僥儉偺僶儔儞僗傪曐偭偰偄傞丅傾億僩乕僔僗傪婲偙偡応崌偵偼丄嵟廔揑偵嵶朎偼堚揱巕偑愗抐偝傟丄慡偰偺婡擻傪幐偭偰丄儅僋儘僼傽乕僕偵傛傞婷怘側偳偵傛傝徚幐偡傞丅
丂傾億僩乕僔僗偵偼擇捠傝偺宱楬偑偁傞丅傂偲偮偼丄懄帪宆帺敋夁掱偲偄傢傟丄枹廋暅偺傑傑偺俢俶俙俀杮嵔愗抐傪p53僞儞僷僋幙巐検懱偑擣幆乮擣幆偟偨俀杮嵔愗抐偑侾偮偱傕埲壓偺夁掱偑婲偙傞乯仺儈僩僐儞僪儕傾傪巋寖仺儈僩僐儞僪儕傾撪偺僠僩僋儘儉們偑曻弌仺帺敋憰抲偺拞悤丄愽嵼宆僇僗僷乕僛僞儞僷僋幙孮偺妶惈壔仺妶惈宆僇僗僷乕僛僞儞僷僋幙暘夝峺慺偑嵶朎幙撪偺悤梫側峔憿暔偺峔惉僞儞僷僋幙傪暘抐丄撪晹夝懱仺俠俙俢僞儞僷僋幙乮俢俶俙暘夝峺慺乯偑夝曻偝傟丄嵶朎妀撪偵怤擖偟偰僋儘儅僠儞俢俶俙傪惍慠偲暘抐乮乣160僰僋儗僆僠僪偺挿偝亖俢俶俙儔僟乕乯丅偲偄偆夁掱傪偲傞丅
丂傕偆堦偮偼抶墑宆帺敋夁掱偱丄懡偔偺傾億僩乕僔僗偼偙偺夁掱偵傛傞偲峫偊傜傟偰偄傞丅俢俶俙懝彎傪俢俶俙-俹俲偑擣幆偟丄帺傜傪妶惈壔仺p53僞儞僷僋幙妶惈壔仺妶惈宆p53僞儞僷僋偑揮幨場巕偲偟偰條乆側僞儞僷僋幙偺憹嶻丄尭嶻傪桿摫仺偦傟傜偺僞儞僷僋幙偺侾偮偑儈僩僐儞僪儕傾傪巋寖仺儈僩僐儞僪儕傾偑僆僉僔僟儞僩曻弌仺僇僗僷乕僛偺妶惈壔仺乧乮埲壓摨偠乯丅偲偄偆夁掱傪偲傞丅
丂偙偙偵弌偰偔傞僇僗僷乕僛偼丄僞儞僷僋幙暘夝峺慺廤抍偱丄摿掕僞儞僷僋幙偺摿掕傾儈僲巁攝楍傪擣幆偟丄偦偺攝楍偺寛傑偭偨応強偩偗傪愗傞丅偡側傢偪丄嵶朎枌丄嵶朎崪奿丄妀側偳偺峔抸暔偺梫強偵巊梡偝傟偰偄傞摿掕偺僞儞僷僋幙傪堦惸偵夝懱偡傞偙偲偵傛偭偰丄庡梫峔抸暔傪堦搙偵撪晹夝懱偝偣丄嵶朎傪嶦偡偺偱偁傞丅偙傟傜偼10庬椶埲忋偑敪尒偝傟偰偄傞偑丄暯帪偵偼懡廳梷惂偑側偝傟偰偄傞丅
俇丏 峫嶡
丂曻幩慄傪徠幩偡傞偲嵶朎偺憹怋棪偑撦傞丅乮師儁乕僕偵柾幃揑側僌儔僼傪帵偡乯
丂偙傟偼曻幩慄偵傛偭偰堚揱巕偵彎奞傪庴偗偨嵶朎偑忋婰乮俀丏彉榑丄俆丏愝栤乯偱弎傋偨婡彉偵傛偭偰傾億僩乕僔僗傪婲偙偡偨傔偱偁傞偲峫偊傜傟傞丅崱夞偺幚廗偱偼丄幚嵺偵儅僂僗偺擕娻桼棃偺晜梀嵶朎偵倃慄傪徠幩偟丄攟梴偟偰偐傜丄俢俶俙傪庢傝弌偟丄揹婥塲摦傪峴偭偰惓忢偺傕偺偲斾妑偡傞偙偲偵傛傝丄倃慄徠幩屻偺嵶朎偑傾億僩乕僔僗傪懡偔婲偙偡偙偲傪妋擣偟偨丅崱夞偺幚廗偱偼俢俶俙儔僟乕偺懚嵼傪偦偺崻嫆偲偟偨偑丄俢俶俙儔僟乕偼傾億僩乕僔僗埲奜偱偼尒傜傟側偄丄偲偄偆摿挜傪帩偮斀柺丄偙傟偑尒傜傟側偄偐傜偲偄偭偰傾億僩乕僔僗偑婲偙偭偰偄側偄丄偲偄偆偙偲傪堄枴偟偰偄傞傢偗偱偼側偄丄偲偄偆揰偱拲堄傪梫偡傞丅俠俙俢僞儞僷僋幙傪憖嶌偟偰丄俢俶俙傪愗抐偱偒側偄傛偆偵偟偰傕丄嵶朎偼傾億僩乕僔僗傪婲偙偡丅乮摉慠俢俶俙愗抐偼婲偙傜側偄乯偮傑傝丄俢俶俙愗抐偼傾億僩乕僔僗嵶朎偺巰場偲偼側傜側偄偺偱偁傞丅
丂幚嵺偺惗懱撪偱偺傾億僩乕僔僗偵偮偄偰丅拞悤恄宱偺拞偱傕擼偺恄宱嵶朎偱偼傾億僩乕僔僗偑昿敪偟偰偄傞偲峫偊傜傟傞丅傑偨丄撪暘斿巟攝傪庴偗傞憻婍偱偼傛偔丄儂儖儌儞掅壓偵傛傞憻婍堔弅偑尒傜傟傞偑丄偙偺帪偵傾億僩乕僔僗偑敪尰偟偰偄傞偲峫偊傜傟偰偄傞丅柶塽宯偱偼傾億僩乕僔僗偑傛偔尋媶偝傟偰偍傝丄庬乆偺応柺偱傾億僩乕僔僗偑廳梫側栶妱傪壥偨偟偰偄傞丅乮庡偵帺屓擣幆偡傞柶塽嵶朎傪攔彍偡傞儊僇僯僘儉丄嵶朎彎奞惈偺俿儕儞僷媴偵傛傞僈儞嵶朎傗僂僀儖僗姶愼嵶朎偺攔彍偺儊僇僯僘儉偵娭學乯
丂傾億僩乕僔僗偺僔僗僥儉偼丄恄宱嵶朎傗撪暘斿柶塽宯側偳傪巌傞嵶朎偺婡擻堐帩側偳丄惗柦尰徾偵廳梫側栶妱傪壥偨偟偰偄傞丅偦偺偨傔丄偦偺堎忢偵傛傞幘姵偼懡婒偵傢偨傞丅乮偑傫丄柶塽幘姵丄姶愼徢丄恄宱幘姵丄撪暘斿幘姵側偳乯
丂偑傫丗暘壔偟偨嵶朎偑傾億僩乕僔僗偐傜堩扙偟偨寢壥丄憹怋擻傪妉摼偟偨堎忢嵶朎偲峫偊傜傟偰偄傞丅
柶塽幘姵丗帺屓斀墳惈俿嵶朎偼傾億僩乕僔僗偵傛傝彍嫀偝傟傞偑丄彍嫀偝傟偢偵枛徑偵弌尰偡傞偲丄偝傑偞傑側帺屓柶塽幘姵傪堷偒婲偙偡丅
姶愼徢丗乮摿偵僂僀儖僗姶愼乯姶愼嵶朎偼傾億僩乕僔僗偵傛傝巰柵偡傞丅
恄宱幘姵丗擼偺嫊寣屻偺恄宱嵶朎偼丄僌儖僞儈儞巁偺曻弌丄嵶朎撪僇儖僔僂儉僀僆儞偺忋徃偵傛傝堦巁壔拏慺嶻惗傪婲偙偟偰嵶朎巰偵帄傞丅傾儖僣僴僀儅乕昦側偳偺曄惈偵傛傞嵶朎巰偲擼堔弅傕拲栚偝傟偰偄傞丅偦偺拞怱揑栶妱傪壥偨偟偰偄傞偺偼傾儈儘僀僪僞儞僷僋幙偲峫偊傜傟偰偄傞丅
撪暘斿幘姵丗儂儖儌儞寚朢偵傛傞昗弨憻婍偺堔弅偵傾億僩乕僔僗偑娭梌偟偰偄傞丅僗僥儘僀僪儂儖儌儞偵傛傞柶塽梷惂嶌梡偲偟偰丄嫻態嵶朎偺傾億僩乕僔僗偑傛偔抦傜傟偰偄傞丅
嶲峫暥專
丂恖偼曻幩慄偵側偤庛偄偐丂戞俁斉丂丂嬤摗廆暯挊丂島択幮僽儖乕僶僢僋僗乮1998乯
丂堛壢惗壔妛丂丂枅揷揙晇傜曇丂島択幮僒僀僄儞僥傿僼傿僢僋乮2000乯
| SEO | [PR] 敋懍!柍椏僽儘僌 柍椏儂乕儉儁乕僕奐愝 柍椏儔僀僽曻憲 | ||
